 |
 |
- Search
| Arch Hand Microsurg > Volume 25(2); 2020 > Article |
|
Abstract
Purpose
The purpose of this study was to report the results of revision total elbow replacement arthroplasty (TERA) with an allograft-prosthesis composite (APC).
Methods
We retrospectively reviewed 6 patients with an average age of 75 years who had undergone revision TERA with an APC for periprosthetic fracture or loosening of the component. The mean follow-up period was 13 months. We assessed serial radiographs for bone union and evaluated the outcomes in terms of pain visual analogue scale (VAS), the Mayo Elbow Performance Score (MEPS), range of motion, and complications.
Results
The APC was used for the humerus in 5 patients and for the ulna in 1 patient. The clinical bone union was achieved at average 9 months after surgery. The mean pain VAS score improved from 6.8 to 1.7, the mean elbow joint range of motion increased from 95° to 129° and the MEPS score improved from 40 to 79 at the last follow-up. There were no major complications such as infection, nonunion, malunion, limitation of motion or refracture. One patient experienced transient radial nerve palsy and another patient a prominent edge of the humeral allobone that needed a trimming surgery later.
주관절의 인공관절 전치환술은 환자의 주관절이 다양한 원인에 의해 심하게 손상되고 관절 기능의 회복이 불가능할 때 효과적인 치료 방법 중 하나이다. 수술적 치료의 적응증은 외상성 관절염, 류마티스 관절염, 심한 퇴행성 관절염, 고령에서 외상으로 인한 심한 분쇄골절, 종양 제거 후 상태 등이 해당된다[1-5]. 주관절의 인공관절 전치환술의 빈도가 증가하고, 인공관절 구조물의 발전에도 불구하고, 고관절, 슬관절 등의 다른 관절의 인공관절 치환술에 비해 재치환술의 비율이 상대적으로 높으며, 여전히 도전적이고 기술적으로 까다로운 수술이다[6]. 주관절의 인공관절 재치환술의 원인은 1차 수술에 삽입된 인공 구조물의 불안정성 및 해리가 흔하며, 이외에도 인공관절 주위골절, 감염, 관절강직 등도 원인으로 생각해볼 수 있다[4,5,7,8]. 주관절의 인공관절의 재치환술에 대한 수술방법은 발생 원인, 1차 수술의 인공 구조물의 삽입 상태, 그리고 술자의 선호도에 따라 다양하다. 인공관절의 재치환술시 발생할 수 있는 거대 골 결손에 대해서도 고려를 해야 되는데, 대표적인 술식으로는 압박 이식술(impaction grafting), 지주 동종골 이식(strut allografts), 용적 동종골 이식(bulk allografts), 맞춤 그리고 비 맞춤 인공물(custom and non-custom prostheses), 그리고 인공구조물 동종골 복합체(allograft-prosthetic composites)를 이용한 재치환술 등이 알려져 있다[1,3,9,10].
이중 인공구조물 동종골 복합체를 이용한 재치환술은 원래 골 종양에 대한 치료 방법으로 주로 사용되었고, 또한 고관절 및 슬관절의 인공관절 재치환술시 선택 가능한 술식이었다. 주관절에서의 사용은 Urbaniak과 Black [11], Urbaniak과 Aitken [12]의 연구에서 처음 보고되었으나, 주관절의 인공관절 전치환술 빈도수가 증가함에도 불구하고, 주관절의 인공관절 재치환술에 대해서는 몇몇 저자에게서만 연구[3,7]가 이루어졌으며, 인공구조물 동종골 복합체를 이용한 재치환술에 대해서는 아직 국내에 결과 보고된 바가 없다. 이에 본 저자들은 주관절의 인공관절 재치환술에서 인공구조물 동종골 복합체를 이용한 재치환술의 치료 결과를 알아보고 유용한 수술적 기법에 대해 소개하고자 한다.
2018년 1월부터 2019년 8월까지 주관절의 인공관절주위골절, 인공구조물 해리 등으로 인공구조물 동종골 복합체를 이용한 재치환술을 받은 환자 6예를 확인하였으며, 이를 대상으로 후향적으로 분석하였다. 수술을 시행할 당시 대상 환자들의 평균 연령은 74.7세(범위, 62−82세)였고, 평균 수술 후 추시 기간은 12.7개월(범위, 6−22개월)이었다. 모든 예에서 여성이고, 오른손잡이였다. 1명은 우세수를 수술하였고, 5명은 비우세수를 수술하였다. 최초 인공관절 전치환술 이후 재치환술을 받기까지 평균 소요기간은 15.2년(범위, 6−28년)이었다. 수술의 원인은 인공구조물 해리가 2예, 인공관절주위골절(Mayo classification of periprosthetic fractures of the humerus and ulna, type II: shaft fractures around the stem [4])이 4예였고, 동종골 사용부위는 상완골 5예, 척골 1예였다(Table 1).
본 연구는 병원 기관윤리심의위원회(Institutional Review Board)의 승인을 받아 진행하였다.
모든 수술은 전신마취하 1명의 술자에 의하여 시행되었으며, 상완에 공기압 지혈대(pneumatic tourniquet)를 최대한 근위부에 감아서 사용하였다. 환자는 앙와위 자세로 위치하고, 한 명의 수술 보조가 팔을 들어 팔꿈치를 90°로 들고 있는 상태에서 수술을 진행하였으며, 이전 수술부위를 따라 주관절 후방부에서 절개하였다. 절개 후 조직을 박리하면서 요골신경 및 척골신경을 확인한 뒤, 삼두근 부착부위는 손상을 최대한 주지 않도록 박리하였다. 이전 수술에 삽입되어 있던 인공관절 구조물과 시멘트를 제거한 뒤, 남아있는 금속을 포함하고 있는 모든 연부조직과 활액막에 대해 변연 절제술을 시행하고, 감염의 원인이 될 수 있는 요소들을 완전히 제거하였다. 추후 발생할 수 있는 감염방지를 위해 동종골은 수술 시작 전에 베타딘 용액에 충분히 담가 두었으며, 척골에 대한 동종골을 사용할 시에는 삼두근 재건을 위해 동종건이 부착된 동종골을 미리 준비하였다. 이후 발생한 골 손실영역에 대해 동종골을 사용하여 크기와 모양에 따라 Burr를 이용하여 상완골과 척골에 대해 충분히 부연법(rimming)을 시행한 뒤, 인공구조물 동종골 복합체를 만들고, 골수강 내 시멘트를 삽입하여 인공구조물(Zimmer Coonrad/Morrey Total Elbow Revision; Zimmer, Warsaw, IN, USA)을 고정하고 동종골과 숙주골을 계단식 응집방식으로 접촉한 뒤, 윈형 강선 결박술(cerclage wiring)로 고정하였다. 이후 삼두근을 비롯한 손상된 신전근과 상완요골근의 일부를 비롯한 굴곡근에 대해 복원술을 시행하고(Fig. 1), 수술장에서 수술부위인 주관절의 관절 운동의 범위, 관절의 안정성 여부를 확인하였으며, 척골신경에 대해 유리술 및 전방 이전술을 시행한 뒤, 수술부위를 봉합하였다.
수술 후 주관절은 창상에 장력이 가해지는 것을 방지하기 위해 130° 신전 상태에서 장상지 부목으로 1주간 고정하였고, 이후 1주간 수시로 부목을 탈착하면서 간헐적 관절 운동을 권유하였다. 항생제(1세대 세팔로스포린계, 1g/1회/IV)는 수술일 기준 8시간 간격으로 헤모박 제거할 때까지 약 3일 사용하였으며, 통상적으로 수술 2주째 환자가 수술부위 감염요인이 없고, 통증 및 부종 등의 증상을 호소하지 않는다면, 부목을 완전히 제거하였고, 주관절의 능동적 관절운동을 시작하였다.
임상적 결과에 대한 분석은 수술 후 최소 6개월 이상의 추시 기간을 두고 수술 전과 후의 시각통증척도(visual analogue scale)로 통증 점수를 측정하여 동통에 대해 평가하였으며, 수술 후 기능적 평가를 위해 최종 추시에서 주관절 운동범위, Mayo Elbow Performance Score (MEPS)를 조사하였다. 주관절 운동범위는 최대 능동 굴곡 각도에서 굴곡 구축 각도를 뺀 것으로 하였다. 영상의학적 평가로는 수술 후 정기적으로 시행한 방사선 사진을 통해 골유합 시기, 인공구조물 동종골 복합체의 유지, 불유합, 부정유합의 유무 등을 확인하였다. 골유합은 골절 부위의 압통이 소실되고 관절 운동 시 통증이 없으며, 전후, 측면 방사선 사진상에서 골절된 피질골이 가골 형성 및 골소주에 의해 3/4 이상 연결된 경우로 하였다[13,14]. 또한 합병증으로는 감염, 감각이상, 불유합 등의 여부를 확인하였다.
모든 환자에서 수술 후 추시 과정에서 골유합을 얻을 수 있었고, 평균 골유합 소요 기간은 9개월(범위, 6−22개월)이었다(Fig. 2). 수술 전의 평균 시각통증척도는 6.8점(범위, 6−7점)이었고, 수술 후 최종 추시 시의 평균 시각통증척도는 1.7점(범위, 1−3점)으로 감소된 소견을 보였다. 주관절의 총 능동 운동 범위는 수술 전 평균 95° (범위, 80°−120°)에서 수술 후 평균 129° (범위, 120°−140°)로 증가하였다. 수술 전 MEPS 점수는 평균 40점(범위, 25−47점; poor) 였으나, 수술 후 최종 추시 시의 MEPS 점수는 평균 79점(범위, 75−83점; good)으로 증가된 소견을 보였다. 수술 후 요골신경 이상(mild loss of extension of fingers, thumb, and wrist)을 호소하였던 환자가 1예 있었으나 지속적인 재활, 물리치료 병행하면서 경과 관찰하였고 수술 후 11개월에 증상이 완전히 호전되었으며, 다른 1예에서 수술 후 동종골의 돌출로 인한 압통을 호소하여 추가적인 수술적 치료를 시행하였고 이후 증상이 호전되었다. 그 외에 6예 전부에서 감염, 부정유합, 불유합, 해리, 운동제한 및 재골절은 추시 기간 동안 관찰되지 않았다(Table 2).
주관절에서 인공관절 재치환술은 수술 이전에 비해 환자의 통증을 감소시키고, 주관절 운동 범위를 증가시키며, 환자로 하여금 일상생활의 회복을 가능하게 한다. 그러나 합병증과 재수술의 비율은 각각, 44%와 22%로 보고되고 있다[5]. 따라서, 주관절의 인공관절 재치환술을 시행하는데 있어서 술자의 술식에 대한 충분한 이해와 신중한 접근이 필요하다. 선택할 수 있는 술식은 다양하나, 통상적으로 환자의 나이, 진단, 주관절의 사용 능력, 그리고 재치환술의 원인(외상, 감염, 해리 등)에 따라 달라질 수 있다. 단순 인공구조물 주위골절이고, 해리가 없는 상태라면 골절 고정수술만으로도 치료할 수 있다고 생각할 수 있으나, 실제로 본 연구에서의 사례처럼 환자가 고령이고, 퇴행성 관절염 또는 류마티스 관절염이 동반된 경우가 대부분이며, 골 상태가 좋지 않고, 분쇄골절 형태이기 때문에 적절한 술식이 아니다. 이중 인공구조물 동종골 복합체를 이용한 재치환술은 인공구조물주위골절, 기존의 삽입된 시멘트 제거 등으로 거대 골 결손이 동반될 수 있는 경우 이를 보완할 수 있다는 장점이 있다[3,4,15].
Morrey 등[3]의 연구에서는 인공구조물 동종골 복합체를 이용한 주관절 재치환술을 시행한 후 추시 결과를 보고하였다. 평균 추시 기간이 3.4년인 총 25예의 증례를 통해 수술 후 추시 기간 동안 통증이 감소하고 운동 범위가 증가하는 호의적인 결과를 얻었다고 하였으며, MEPS 점수도 증가된 것으로 보고하였다. 하지만, 감염(3예), 재골절(3예), 불유합(1예), 부정유합(1예), 피부괴사(1예), 삼두근 손상 및 약화(1예), 척골신경 이상(1예) 등의 합병증이 발생한 사례가 있었다고 보고하였다.
Amirfeyz와 Stanley [7]의 연구에서도 총 14예의 증례를 통해 인공구조물 동종골 복합체를 이용한 주관절 재치환술을 시행한 후 감염이 발생한 1예를 제외하고, 평균 75개월의 추시 기간 동안 주관절의 일상 활동이 가능하고 좋은 결과를 얻었다고 보고하였다. 또한, 주관절의 인공구조물의 삽입부위에 해당되는 상완골과 척골에서 동종골의 골흡수의 비율은 차이가 없었다. 그러나 숙주골과 동종골의 연결부위에서 상완골과 척골의 골흡수 양상이 다를 수 있음을 방사선학적으로 비교 분석하였는데, 상완골에서는 완전한 골흡수, 척골에서는 근위부의 배측피질에서 골흡수를 보였다. 이는 상완골 부위에 혈액공급이 더 좋기 때문이라고 언급하였는데, 이를 토대로 동종골을 사용한 부위에 따라 인공관절 재치환술의 수명에 영향을 줄 수 있음을 보고하였다. 따라서 이러한 점을 사전에 인지하고 술 후 정기적인 추시 관찰이 필요하다.
본 연구에서 시행한 술식은 이전의 연구에서 제시한 술식과 다른 점이 있는데, 기존에는 삼두근 재건시 직접 봉합하거나, anconeus transfer, achilles tendon allograft 등의 방법을 사용하였으나, 저자들은 동종건이 부착된 척골을 사용하여 다른 술식에 비해 효과적으로 삼두근 재건을 할 수 있었다. 이는 경골 및 상완골의 근위부 등의 골 종양에서 사용되는 술식에서 착안하였다[16,17]. 또한 대부분의 연구에서 골수강 내에 삽입된 시멘트는 인공구조물 고정을 위해 사용되지만, 골유합에 방해를 일으키므로 주의해야 한다고 언급하고 있다[2,3,15]. 하지만, 본 연구에서는 숙주골과 동종골의 연결부위까지 침범되지 않으면 방사선 추시상, 골유합에 지장을 주지 않았다. 그리고 이전 연구에서는 동종골과 숙주골을 고정하는 방식에 대해 3가지로 분류하고 있는데, 숙주골 안에 동종골을 삽입하는 방식, 동종골과 숙주골을 계단식 응집 방식(step-cut coaptation)으로 접촉하는 경우, 그리고 숙주골과 동종골간에 피질골을 부착하는 방식이다[3]. 이에 본 연구에서는 동종골과 숙주골을 계단식 응집 방식으로 접촉한 뒤, 원형 강선 결박술로 고정하였는데, 이는 다른 방식에 비해 거대 골 결손에 대한 재건술로 적합하고 안정적인 고정력을 얻을 수 있는 장점이 있다. 그리고 이전 연구에서는 주관절의 인공관절 재치환술의 흔한 합병증으로 감염을 제시하였는데, 이에 대한 예방을 위해 수술 전 혈액검사를 통해 감별을 할 수 있고, 시멘트 사용시 vancomycin을 혼합하여 사용하거나, 감염이 의심될 경우 수술 시야상에서 조직 배양 및 동결 검사를 시행하기도 하였으며, 짧은 수술시간도 감염에 영향을 미치는 요인으로 제시하기도 하였다[3,15]. 본 연구에서는 동종골을 수술 시작 전에 베타딘 용액에 충분히 담가 두었는데[18,19], 이러한 방법을 통해서 수술 이후 감염에 대한 합병증은 발생하지 않았다. 그리고 신경손상에 대해서는 이전 연구에서 척골신경 유리술 및 전방 이전술을 시행하도록 권장하였고, 요골 신경은 수술 시 정확한 위치 확인을 해야 하며, 상완골의 경우에 시멘트 노출에 의한 신경 손상을 주의해야 한다고 하였다[3,4,7,15]. 본 연구에서 일시적인 요골신경 이상을 호소한 환자의 경우, 요골 신경의 해부학적 구조와 수술 과정을 고려해 보았을 때, 주관절의 근위부에 대한 수술적 접근시, 토니켓(tourniquet)을 풀지 않은 상태에서 요골신경의 확인 및 가동을 도모하였기 때문으로 생각된다. 따라서, 환자의 상태(비만정도, 나이, 수술시야상 출혈 정도 등)에 따라 토니켓 사용에 주의를 기울일 필요가 있다. 또한, 연부조직이 비교적 얇은 환자의 경우에는 동종골의 돌출된 부분에 의해 통증을 유발할 수 있기 때문에 수술 시에 이 부분을 고려하여야 한다(Table 3).
본 연구의 한계점으로는 첫째 후향적 연구로 인공구조물 동종골 복합체를 이용한 주관절 재치환술 외의 수술을 시행한 대조군이 없어 결과를 비교하거나 일반화하기 어렵다는 것이다. 둘째로는 추시 기간이 비교적 짧아 장기적인 임상 결과를 보이는 데에는 한계가 있다. 향후에는 여러 수술적 치료 방법의 장기 추시 비교 연구가 필요할 것으로 판단된다. 비록 연구 대상의 수가 6예이지만, 모든 증례는 인공구조물 동종골 복합체를 이용한 주관절의 인공관절 재치환술을 동일한 술식으로 진행한 예후를 개괄적으로 보기에 의미 있는 자료라고 생각한다.
Fig. 1.
A 76-year-old woman with periprosthetic fracture in the proximal ulna. (A) Preoperative radiographs, (B) postoperative radiographs. (C) In the intraoperative field, we used the tendon-attached ulnar allobone for triceps reconstruction. The tendon-attached ulnar allobone (black arrowhead) was coapted with the hostbone in a step-cut configuration with cerclage wiring fixation. (D) The triceps musculotendinous part was sutured (black arrowhead) to the allotendon that is attached to the allobone. (E) Follow-up radiographs taken at 6 months after surgery show callus formation at the junction between the allobone and hostbone.
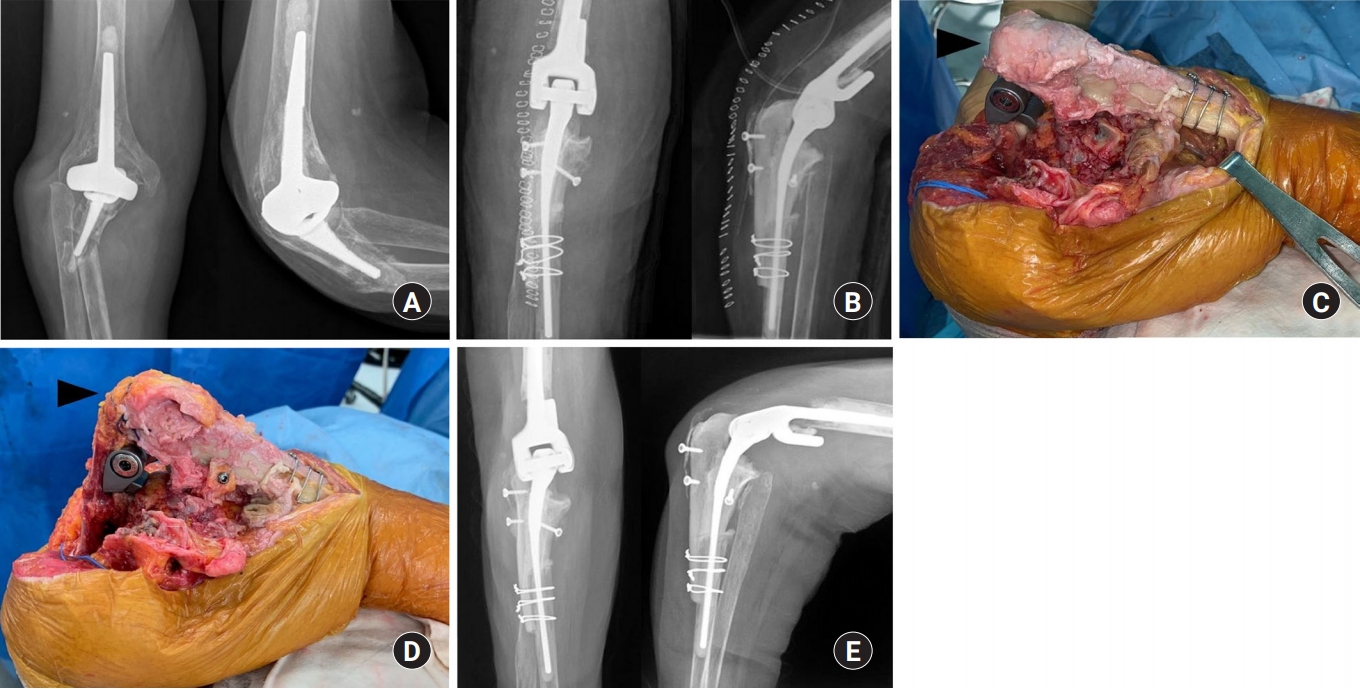
Fig. 2.
A 76-year-old woman with periprosthetic fracture in distal humerus. (A) Preoperative radiographs, (B) postoperative radiographs show step-cut coaptation with cerclage wiring fixation, use of a long stem with firm cementing in the humerus. (C) Follow-up radiographs taken at 9 months after surgery show bone union at the junction between the allobone and hostbone.
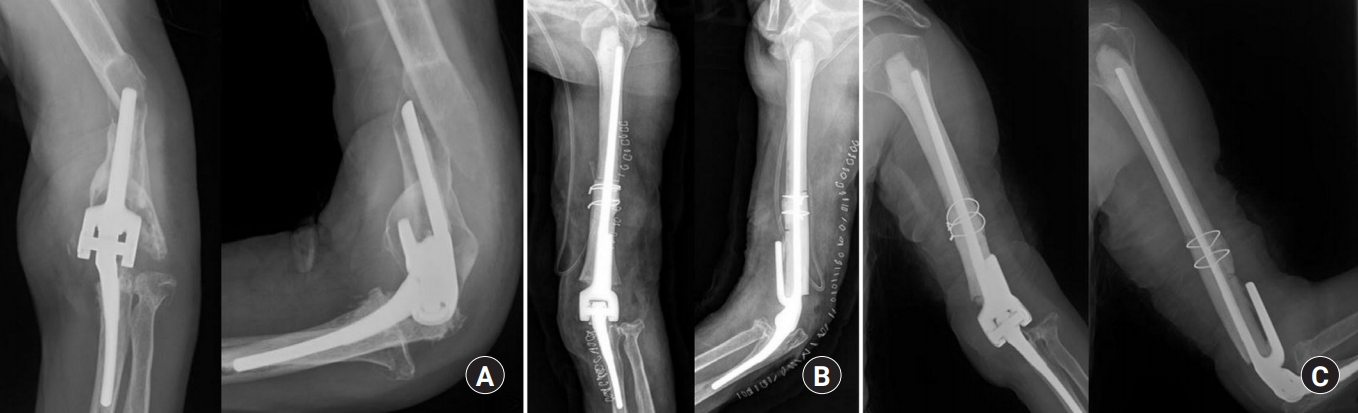
Table 1.
Demographic data of patients
Table 2.
Summary of results for the patients
Table 3.
Authors’ recommended technical points for revision TERA with an APC
REFERENCES
1. Lee DH. Impaction allograft bone-grafting for revision total elbow arthroplasty: a case report. J Bone Joint Surg Am. 1999;81:1008-12.


2. Renfree KJ, Dell PC, Kozin SH, Wright TW. Total elbow arthroplasty with massive composite allografts. J Shoulder Elbow Surg. 2004;13:313-21.


3. Morrey ME, Sanchez-Sotelo J, Abdel MP, Morrey BF. Allograft-prosthetic composite reconstruction for massive bone loss including catastrophic failure in total elbow arthroplasty. J Bone Joint Surg Am. 2013;95:1117-24.


4. Ramirez MA, Cheung EV, Murthi AM. Revision total elbow arthroplasty. J Am Acad Orthop Surg. 2017;25:e166-74.


5. Geurts EJ, Viveen J, van Riet RP, Kodde IF, Eygendaal D. Outcomes after revision total elbow arthroplasty: a systematic review. J Shoulder Elbow Surg. 2019;28:381-6.


6. Day JS, Lau E, Ong KL, Williams GR, Ramsey ML, Kurtz SM. Prevalence and projections of total shoulder and elbow arthroplasty in the United States to 2015. J Shoulder Elbow Surg. 2010;19:1115-20.


7. Amirfeyz R, Stanley D. Allograft-prosthesis composite reconstruction for the management of failed elbow replacement with massive structural bone loss: a medium-term follow-up. J Bone Joint Surg Br. 2011;93:1382-8.


8. Little CP, Graham AJ, Karatzas G, Woods DA, Carr AJ. Outcomes of total elbow arthroplasty for rheumatoid arthritis: comparative study of three implants. J Bone Joint Surg Am. 2005;87:2439-48.


9. Bicknell RT, Hughes JS. A new technique for management of ulnar bone loss in revision total elbow arthroplasty using a tuberized tricortical iliac crest autograft: a case report. J Shoulder Elbow Surg. 2008;17:e15-8.

10. Rhee YG, Cho NS, Parke CS. Impaction grafting in revision total elbow arthroplasty due to aseptic loosening and bone loss. J Bone Joint Surg Am. 2013;95:e741-7.


11. Urbaniak JR, Black KE Jr. Cadaveric elbow allografts: a six-year experience. Clin Orthop Relat Res. 1985;(197):131-40.

12. Urbaniak JR, Aitken M. Clinical use of bone allografts in the elbow. Orthop Clin North Am. 1987;18:311-21.


13. Head WC, Wagner RA, Emerson RH Jr, Malinin TI. Revision total hip arthroplasty in the deficient femur with a proximal load-bearing prosthesis. Clin Orthop Relat Res. 1994;(298):119-26.


15. Mansat P, Adams RA, Morrey BF. Allograft-prosthesis composite for revision of catastrophic failure of total elbow arthroplasty. J Bone Joint Surg Am. 2004;86:724-35.


16. King JJ, Nystrom LM, Reimer NB, Gibbs CP Jr, Scarborough MT, Wright TW. Allograft-prosthetic composite reverse total shoulder arthroplasty for reconstruction of proximal humerus tumor resections. J Shoulder Elbow Surg. 2016;25:45-54.


17. Gautam D, Malhotra R. Megaprosthesis versus allograft prosthesis composite for massive skeletal defects. J Clin Orthop Trauma. 2018;9:63-80.


-
METRICS

-
- 1 Crossref
- 3,416 View
- 78 Download
- Related articles in Arch Hand Microsurg






