서론
두피와 두개골은 뇌를 보호하는 중요한 역할을 한다. 두피, 두개골 결손의 원인은 다양하지만, 외상이 가장 흔하고 그 외에도 악성종양, 선천성 질환, 방사선 치료 후 괴사 등이 있다[
1]. 두개 절제술, 두개골 성형술 후에 생긴 두피, 두개골, 경막의 감염은 쉽게 치료되지 않고 재발하며 치명적일 수 있다. 특히 인공 뼈, 티타늄과 같은 이물질을 사용한 신경외과적 수술 이후 감염이 발생했을 때는 항생제 치료로 쉽게 조절되지 않고, 뇌를 보호하는 두개골이 없는 상태에서는 감염이 쉽게 퍼질 수 있으며, 경막외 농양, 수막염, 뇌염으로 이어질 수 있다. 이러한 감염이 동반된 두피, 두개골 결손부를 재건하는 데는 피부 이식술, 국소 피판술, 지역 피판술, 조직 확장술 및 유리 피판술이 이용되고 있다. 피부 이식은 감염이 동반된 결손부에는 적합하지 않고, 생착되더라도 미관상 좋지 않으며 경막 및 뇌를 보호하는 데 한계가 있다. 국소 피판술의 경우 결손부가 클 경우 비탄력적인 두피의 특성상 결손부를 수복하는 데 어려움이 있다. 지역 피판술 및 유리피판술은 앞서 말한 단점들은 보완하는 좋은 방법으로, 최근에는 미세수술이 발전하면서 수술 후 성공률이 높은 유리 피판술이 많이 이용되고 있다[
2]. 저자들은 외상, 뇌동맥류의 파열로 인한 두개내 출혈에 대해 두개 절제술, 두개골 성형술을 시행한 이후 발생한, 감염을 동반한 두피 및 두개골 결손을 유리 피판술을 이용하여 재건하였고 그 결과에 대해 고찰해보고자 한다.
대상 및 방법
2011년 9월부터 2019년 8월까지 신경외과적 수술 이후 발생한 감염을 동반한 두피 및 두개골 결손부에 대해 유리 피판술을 시행한 환자들을 대상으로 후향적으로 연구하였다. 나이, 성별, 병인, 감염을 일으킨 신경외과적 수술, 감염의 양상, 감염의 기간, 동정된 균, 유리 피판술 이전에 시행된 수술적 치료에 대해 조사하였다. 환자들은 모두 유리 피판술을 시행받았고 결손부의 위치, 크기, 시행된 유리 피판술의 종류, 수혜부 혈관 문합, 유리 피판술 전후 의식 상태 및 전반적 상태 변화, 유리 피판술 후 합병증, 추적 관찰 기간을 조사하여 감염의 조절에 대한 유리 피판술의 효과를 연구하였다. 본 연구는 한림대학교 강남성심병원의 기관연구심의위원회에 의해 승인하에 진행하였고(No. 2020-10-010), 모든 환자로부터 동의를 받았다.
결과
총 6명의 환자들 중 남자는 3명, 여자는 3명이었고 연령대는 33세부터 71세까지 다양하였다. 결손의 원인으로는 외상(교통사고, 전기화상, 추락)이 5예로 가장 많았고 1예는 뇌동맥류의 파열로 인한 지주막하 출혈 후 발생한 결손이었다.
두피, 두개에 시행한 첫 수술로는 두개 절제술, 두개 성형술, 두개 절개술, 관혈적 정복술 및 내고정술, 뇌동맥류 결찰술, 가피 절제술이 있었고 3예에서 인공 뼈, 티타늄 플레이트, 나사, 메쉬와 같은 이물질이 사용되었다. 감염은 모두 두개내 감염을 동반한 두피 감염이었다. 2예는 경막, 두개골이 노출된 열린 창상의 양상이었고 4예는 경막외 농양의 양상이었다. 경막외 농양의 양상 중 1예에는 수막염이 동반되어 있었다. 결손부에서 동정된 균은 3예에서 methicillin-resistant Staphylococcus aureus, 1예에서 carbapenem-resistant Acinetobacter baumannii, methicillin-resistant coagulase-negative staphylococci, Staphylococcus epidermidis가 각각 배양되었고, 6예 중 5예에서 항생제 내성균이 배양되었다.
첫 번째 수술 이후 유리 피판술로 감염이 조절되기 전까지 감염이 지속된 기간은 4.3±2.6개월이었고(범위, 1–8개월), 한두 차례 수술적으로 치료하였으나 감염은 조절되지 않았다(
Table 1). 감염이 동반된 결손부의 위치는 3예가 측두부였고, 2예가 측두 두정부, 1예가 전두부였다. 결손부의 크기는 최소 2×3 cm에서부터 최대 21×15 cm까지 다양하였다. 결손부의 크기 및 위치, 수혜부 혈관 상태에 따라 적절한 유리 피판술을 선택하였고, 3예에서 광배근 피부 피판을, 1예에서 광배근 피판, 측두 근막 피부 피판, 대망 피판을 각각 시행하였다(
Fig. 1).
공여부는 모두 일차봉합을 하였다. 수혜부 혈관 문합을 위해서 얕은 관자 동, 정맥이 가장 많이 이용되었고(4예), 전두부 결손부를 가진 환자에서는 얼굴동맥, 내경정맥이 이용되었으며 1예에서는 얕은 관자동맥, 얼굴정맥(대복재정맥 이식편 이용)이 이용되었다(
Table 2).
유리 피판술을 시행하기 전 1예는 경막외 농양, 수막염으로 인해 혼미한 정신 상태였고, 유리 피판술 후 명료한 의식 상태를 회복하였다. 유리 피판술 후 혈종, 장액종, 감염의 재발, 공여부 합병증 등과 같은 주요 합병증 없이 수술 부위가 회복되었고 59.3±42.0개월(범위, 15–123개월) 동안 추적 관찰하였다(
Table 3).
고찰
다양한 원인에 의해 발생하는 두피, 두개골의 결손부의 재건은 고려해야 할 요소들이 많아 재건 성형 의사의 깊은 고민을 요한다. 가장 중요한 기관인 뇌를 보호하는 기능뿐만 아니라, 노출되어 있는 부위이기 때문에 두부의 윤곽, 모양, 모발의 상태, 흉터 등 미용적인 요소도 고려해야 한다[
3]. 재건에 앞서 감염이 동반된 두피, 두개골 결손부에 대해 광범위한 죽은 조직 절제술이 필수적이다. 6예 중 5예에서 지속적인 죽은 조직 제거술 및 봉합에도 감염이 조절되지 않고 창상의 호전이 없었는데, 이는 감염이 동반된 조직에 대한 광범위한 죽은 조직 제거가 완전히 이뤄지지 않았기 때문이라고 저자들은 생각한다. 또한 이물질이 있을 경우 감염이 일어날 가능성이 1,000배 증가하게 되므로[
4], 광범위한 죽은 조직의 제거와 함께 이물질의 제거 또한 필수적이다. 6예 중 3예에서 이물질이 잔존하고 있었고(인공 뼈, 티타늄 플레이트, 나사, 메쉬), 저자들은 결손부 수복에 앞서 이물질을 모두 제거하였다.
6예 중 5예에서 항생제 내성균이 동정되었다. 항생제 내성이란 균이 항생제의 효과에 저항하는 능력을 말한다[
5]. 경험적 항생제 요법에 내성이 있는 균의 경우 효과적으로 치료되지 않아 상처 치유가 지연되고, 특히 두피 및 두개의 항생제 내성균 감염을 동반한 만성 상처는 경막외 농양, 수막염, 뇌염으로 이어질 수 있어 치명적이다. 과거에는 감염이 적절히 조절된 이후에 결손부를 수복해야 하는 것으로 생각했다[
6]. 따라서 결손부의 수복이 늦춰질 수밖에 없었고, 만성 창상으로 인한 환자의 상태는 더욱 악화되었다. 게다가 항생제 내성균으로 인한 만성 창상은 감염의 조절이 쉽지 않아, 창상이 더 악화될 수 있고 결손부의 적절한 수복 시기를 놓치게 되어 두피 및 두개 결손부 환자에서는 치명적인 결과를 초래할 수 있다. 이에 저자들은 조기에 과감하게 유리 피판술을 통한 결손부의 수복을 시행하였고 만족할 만한 결과를 얻었다.
두피 및 두개의 재건 방법에는 국소 피판술, 조직 확장술, 유리 피판술과 같은 다양한 방법들이 있고 저자들은 적절한 재건 방법의 결정에 있어서 많은 고민을 하였다. 크기가 크지 않은 두피의 결손부에 대해서는 국소 피판술을 시행해볼 수 있다. 주변 조직을 이용하기 때문에 수술 후 이질감이 없고 머리카락 또한 보존할 수 있다. 하지만 결손부가 클 경우 국소 피판술의 공여부를 일차봉합하기 어렵고, 피판이 커질수록 혈액 공급 또한 불안정해진다. 게다가 외상, 방사선 치료로 인한 두피, 두개골의 결손부가 있는 환자에서는 결손부 주위의 조직 또한 손상되었을 가능성이 크기에 적절하지 않다[
7]. 조직 확장술은 크기가 큰 결손부에서도 사용할 수 있으며 머리카락을 보존할 수 있다는 점에 있어서 수술 후 미용적인 효과가 뛰어나다. 하지만 치료 기간이 길고 수술 후 조직 확장 기간에 대한 환자의 순응도가 떨어진다. 그리고 두개골의 결손과 감염이 동반되어 있을 경우 수술 후 합병증의 발생 가능성이 크므로 적절하지 않다[
3].
유리 피판술은 앞서 말한 단점들을 보완하는 좋은 방법으로, 혈액 공급이 풍부하여 감염 조절 및 창상 회복에 효과적이다. 수술 시간이 길어지고 피판의 손실 가능성이 있다는 단점이 있지만, 최근에는 미세수술의 발전으로 인해 수술 후 성공률이 높아져서 저자들은 다양한 유리 피판술을 우선 고려하였다[
8]. 두피, 두개골의 결손부에 사용할 수 있는 유리 피판에는 대망 유리 피판, 서혜부 피판, 광배근 피판, 요측 전완 피판, 복직근 피판, 전외측 대퇴부 피판 등이 있는데[
9-
12], 저자들은 6예 중 4예에서 광배근 유리 피판술을 시행하였다. 광배근 유리 피판술은 넓고 두꺼운 연부조직을 채취할 수 있고, 일정한 크기의 혈관경을 가지고 있으며, 혈관 분포가 풍부하며 피판을 들어올리기가 비교적 수월하다는 장점이 있다. 그러나 두 팀 접근이 쉽지 않으며, 시간이 지남에 따라 근육의 위축으로 인해 부피가 감소한다는 단점이 있다[
13,
14]. 4예 모두 결손부가 넓고(13×12 cm, 14×13 cm, 15×8 cm, 21×15 cm) 두개골의 결손을 동반하고 있어, 광범위한 사강을 수복할 수 있는 피판이 필요하였다. 저자들은 접근하기 쉽고, 혈관경이 일정하며 넓고 적절한 두께를 가진 광배근의 유리 피판술을 이용하여 재건하였다. 또한 저자들은 광배근 피판의 근육이 시간이 지남에 따라 위축한다는 단점을 이용하여 수술 후 피판이 위축됨에 따라 피판의 비대가 가라앉으며 미용적 효과가 증대되도록 하였다.
두피 및 두개골의 결손부를 수복할 때 수여부 혈관경으로는 얕은 관자 동, 정맥이 많이 이용된다[
8]. 이외에도 외경동맥, 내경정맥의 가지들을 사용할 수 있는데[
15], 저자들은 얕은 관자 동, 정맥이 보존되어 있을 경우에는 그것을 이용하였으며, 손상 시에는 대복재정맥 이식편을 이용하기도 하였다. 감염의 재발, 혈종, 장액종 등 주요 합병증 없이 치유되었으며, 감염이 어느 정도 조절될 때까지 두개골 성형술은 시행하지 않았다. 2예에서 유리 피판술을 이용한 재건 후 추적 관찰 기간 동안 피판의 위축에 따른 두피의 함몰이 나타났고 이런 환자에서는 3차원 프린팅을 통한 환자 맞춤 티타늄 메쉬를 이용하여 이차적인 두개 성형술을 시행하였다(
Fig. 2) [
16]. 대망 유리 피판술을 시행한 환자에서는 시간이 지나며 전두부의 함몰이 생겼고, 7차례의 자가지방 이식술을 시행하여 함몰부위를 교정하였다. 감염 조절을 위해 혈액 순환이 풍부한 유리 피판술을 시행했기에, 이차적으로 이물질을 이용한 두개 성형술이나 자가 지방 이식술을 시행했음에도 이물 반응, 감염, 염증 등의 합병증 없이 만족할 만한 미용적 결과를 얻었다.
결론
두피 및 두개골에 대한 신경외과적 수술 이후에 나타나는 두개내 감염은 환자의 생명을 위협할 수 있고 치명적인 후유증을 남길 수 있다. 저자들은 항생제 내성균을 동반한 두개내 감염의 조절을 위해 이물질과 광범위한 감염조직을 제거하고, 조기에 혈액 공급이 풍부한 유리 피판술을 이용한 재건을 시행하여 만족할 만한 결과를 얻었다. 또한 유리 피판술을 통해 감염이 조절된 이후에는 티타늄 메쉬를 이용한 두개 성형술 또는 자가 지방 이식술을 통한 이차적인 교정수술을 감염의 재발 없이 안전하게 시행할 수 있었고 뛰어난 기능적, 미용적 효과를 얻었다.
Conflicts of interest
The authors have nothing to disclose.
Fig. 1.
(A, B) A 62-year-old male with epidural abscess. (C) Latissimus dorsi muscle free flap was harvested. (D) Immediate postoperation. (E) A 33-year-old male visited the clinic for a 2×3-cm sized defect with methicillin-resistant Staphylococcus aureus infection. (F) Contralateral temporal fasciocutaneous free flap was harvested and anastomosed with superficial temporal vessels. (G) Immediate postoperation. Written informed consent was obtained for publication of this study and accompanying images.
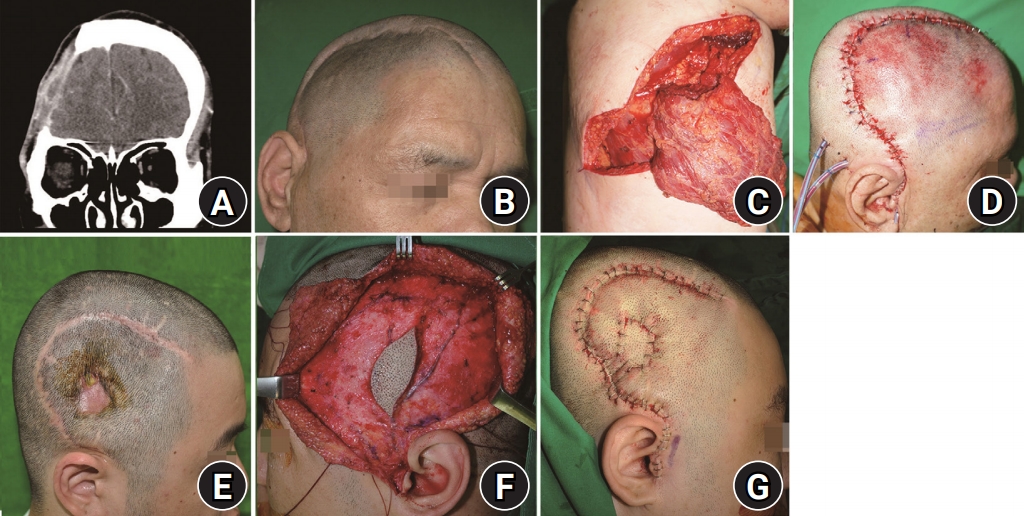
Fig. 2.
(A) Postoperative 19 months. As latissimus dorsi muscle was atrophied, depression on the temporal area became prominent. (B) After 1 year of cranioplasty using three-dimensional (3D) customized titanium mesh, there was excellent aesthetic results without recurrence of infection. (C) Plain film. Titanium mesh was covered over the temporal area. (D) Postoperative 108 months. As temporal fascia free flap was atrophied, depression on the temporal area became prominent. (E) After 1 month of cranioplasty using 3D customized titanium mesh, there were excellent aesthetic results without recurrence of infection. (F) Plain film. Titanium mesh was covered over the temporal area. Written informed consent was obtained for publication of this study and accompanying images.
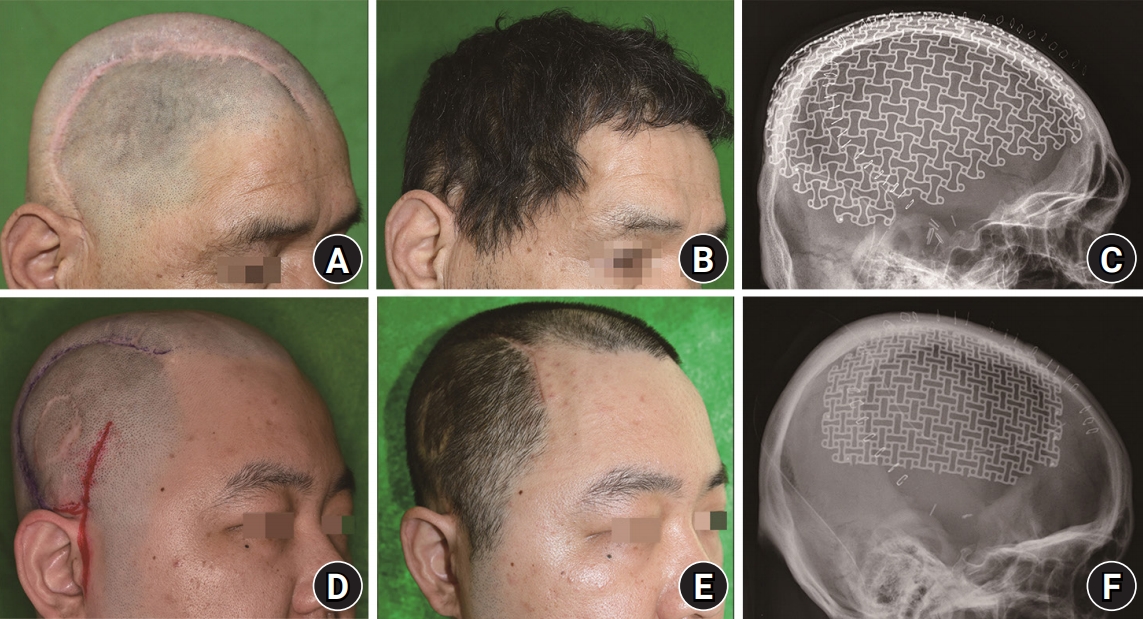
Table 1.
|
Patient No. |
Age (yr) |
Sex |
Etiology |
Operation on scalp and skull |
Foreign body |
Feature of infection |
Culture |
Duration of infection (mo) |
Operative procedure before free flap |
|
1 |
33 |
Male |
Traffic accident |
Craniectomy |
Artificial bone |
Open wound with artificial dura exposure |
MRSA |
6 |
Wound revision with artificial bone removal |
|
Cranioplasty with artificial bone |
Artificial dura |
|
2 |
52 |
Female |
Traffic accident |
Craniotomy |
Titanium plate and screw |
Open wound with frontal bone exposure |
MR-CNS |
5 |
Septal cartilage coverage |
|
ORIF with titanium plate and screw |
Metal removal and acellular dermal matrix (Matriderm) apply |
|
3 |
53 |
Male |
Electric burn |
Escharectomy |
- |
Epidural abscess |
MRSA |
2 |
- |
|
4 |
44 |
Female |
Aneurysm rupture |
Aneurysm neck clipping |
- |
Epidural abscess |
CRAB |
1 |
Irrigation and debridement |
|
Craniectomy |
Meningitis |
Irrigation and debridement |
|
5 |
62 |
Male |
Fall down |
Craniectomy |
- |
Epidural abscess |
MRSA |
8 |
Wound revision |
|
6 |
71 |
Female |
Traffic accident |
Craniectomy |
Titanium mesh |
Epidural abscess with titanium mesh exposure |
Staphylococcus epidermidis
|
4 |
Titanium mesh removal |
|
Cranioplasty with titanium mesh |
Table 2.
Selection of free flaps and recipient vessels according to the area and size of defects
|
Patient No. |
Age (yr) |
Sex |
Defect area |
Defect size (cm) |
Free flap |
Recipient vessel |
|
1 |
33 |
Male |
Right temporal |
2×3 |
Temporal fasciocutaneous |
Superficial temporal vessels (end to end) |
|
2 |
52 |
Female |
Right frontal area |
4×2 |
Omental |
Facial artery (end to end) |
|
Internal jugular vein (end to side) |
|
3 |
53 |
Male |
Left temporal |
14×13 |
Latissimus dorsi musculocutaneous |
Superficial temporal vessels (end to end) |
|
4 |
44 |
Female |
Left temporoparietal |
21×15 |
Latissimus dorsi musculocutaneous |
Superficial temporal vessels (end to end) |
|
5 |
62 |
Male |
Right temporal |
13×12 |
Latissimus dorsi muscle |
Superficial temporal vessels (end to end) |
|
6 |
71 |
Female |
Left temporoparietal |
15×8 |
Latissimus dorsi musculocutaneous |
Superficial temporal artery (end to end) |
|
Facial vein (end to end, great saphenous vein graft) |
Table 3.
Efficacy of free flaps and secondary procedures
|
Patient No. |
Age (yr) |
Sex |
Preoperative mental status |
Postoperative mental status |
Complication |
Recurrence of infection |
Follow-up (mo) |
Secondary procedure after free flap coverage |
|
1 |
33 |
Male |
Alert |
Alert |
None |
None |
123 |
Cranioplasty using patient customized titanium mesh |
|
2 |
52 |
Female |
Alert |
Alert |
None |
None |
96 |
Fat graft with stem cell injection |
|
3 |
53 |
Male |
Alert |
Alert |
None |
None |
50 |
- |
|
4 |
44 |
Female |
Stupor |
Alert |
None |
None |
24 |
- |
|
5 |
62 |
Male |
Alert |
Alert |
None |
None |
48 |
Cranioplasty using patient customized titanium mesh |
|
6 |
71 |
Female |
Alert |
Alert |
None |
None |
15 |
- |
REFERENCES
1. Lutz BS, Wei FC, Chen HC, Lin CH, Wei CY. Reconstruction of scalp defects with free flaps in 30 cases. Br J Plast Surg. 1998;51:186-90.


2. Chang KP, Lai CH, Chang CH, Lin CL, Lai CS, Lin SD. Free flap options for reconstruction of complicated scalp and calvarial defects: report of a series of cases and literature review. Microsurgery. 2010;30:13-8.


5. Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012;18:268-81.


7. Boeckx WD, van der Hulst RR, Nanhekhan LV, De Lorenzi F. The role of free flaps in the treatment of persistent scalp osteomyelitis. Neurosurgery. 2006;59(1 Suppl 1):ONS64-7.

8. Oh SJ, Lee J, Cha J, Jeon MK, Koh SH, Chung CH. Free-flap reconstruction of the scalp: donor selection and outcome. J Craniofac Surg. 2011;22:974-7.


9. McLean DH, Buncke HJ Jr. Autotransplant of omentum to a large scalp defect, with microsurgical revascularization. Plast Reconstr Surg. 1972;49:268-74.


10. Kaplan H, Wexler MR, Fiensod M. Free groin flap for the reconstruction of the scalp following tumor resection. Ann Plast Surg. 1979;2:445-7.


11. Tanaka Y, Miki K, Tajima S, Akamatsu J, Tsukazaki Y, Inomoto T. Reconstruction of an extensive scalp defect using the split latissimus dorsi flap in combination with the serratus anterior musculo-osseous flap. Br J Plast Surg. 1998;51:250-4.


12. Santamaria E, Granados M, Barrera-Franco JL. Radial forearm free tissue transfer for head and neck reconstruction: versatility and reliability of a single donor site. Microsurgery. 2000;20:195-201.


13. Lipa JE, Butler CE. Enhancing the outcome of free latissimus dorsi muscle flap reconstruction of scalp defects. Head Neck. 2004;26:46-53.


14. Bailey SH, Oni G, Guevara R, Wong C, Saint-Cyr M. Latissimus dorsi donor-site morbidity: the combination of quilting and fibrin sealant reduce length of drain placement and seroma rate. Ann Plast Surg. 2012;68:555-8.


15. O’Connell DA, Teng MS, Mendez E, Futran ND. Microvascular free tissue transfer in the reconstruction of scalp and lateral temporal bone defects. J Craniofac Surg. 2011;22:801-4.













